Científica de la FDA imparte conferencia sobre regulación de medicamentos
Por Oswal Alonso
En el último Seminario Web de 2021 en el Centro de Investigaciones Químicas (CIQ) de la Universidad Autónoma del Estado de Morelos (UAEM), se presentó la científica mexicana María Teresa Gutiérrez-Lugo de Food and Drug Administration (FDA, por sus siglas en inglés), quien presentó el pasado 8 de diciembre la conferencia Regulación de medicamentos como área profesional.
La egresada como Química Farmacobióloga de la Universidad Nacional Autónoma de México (UNAM) y doctorada en Ciencias Químicas en Farmacia, habló de las oportunidades que pueden tener los profesionales de esta área del conocimiento en las agencias que revisan los procesos para la autorización de fármacos para las enfermedades.
Dio un panorama del proceso de desarrollo de medicamentos, del papel de los químicos farmacobiólogos en este proceso de desarrollo de medicamentos, los productos biológicos y una descripción del organismo regulador de medicamentos en donde trabaja, la FDA.
Explicó que el proceso de revisión de medicamentos tiene como objetivo principal asegurarse que los fármacos sean seguros y efectivos y para eso se sujetan a un riguroso proceso de evaluación que incluyen, por ejemplo, el diseño de los estudios clínicos de los resultados y también la manera en que se producen estos medicamentos.
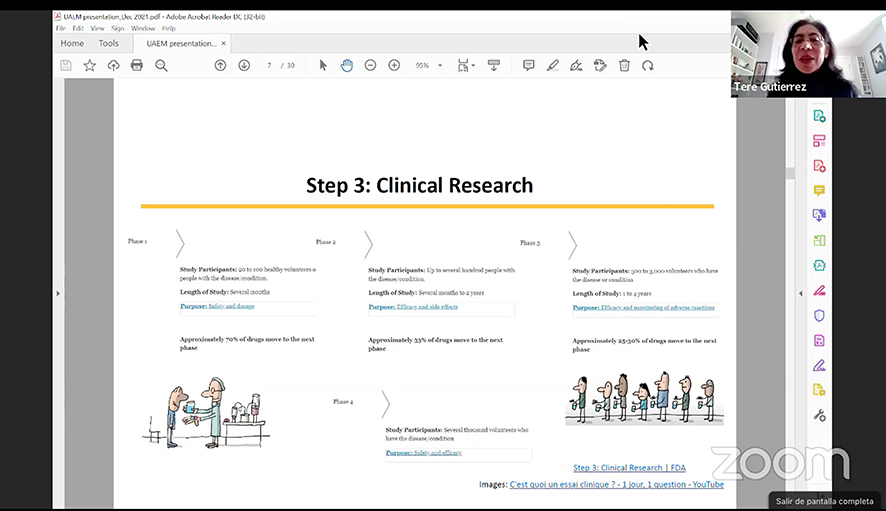
“Estos fármacos se regulan desde que están en desarrollo clínico para la aprobación y después el desarrollo de medicamentos exige varios pasos, el primero es el descubrimiento y desarrollo, después pasar a una investigación preclínica o estudios en animales, luego la investigación clínica en humanos y más adelante, se sujetan a la revisión regulatoria para solicitar la comercialización de estos productos a diferentes agencias regulatorias, la FDA o la Cofepris para el caso de México, dependiendo del país”, señaló Gutiérrez-Lugo, quien agregó que el procedimiento obliga también, en la FDA, a realizar un monitoreo de seguridad.
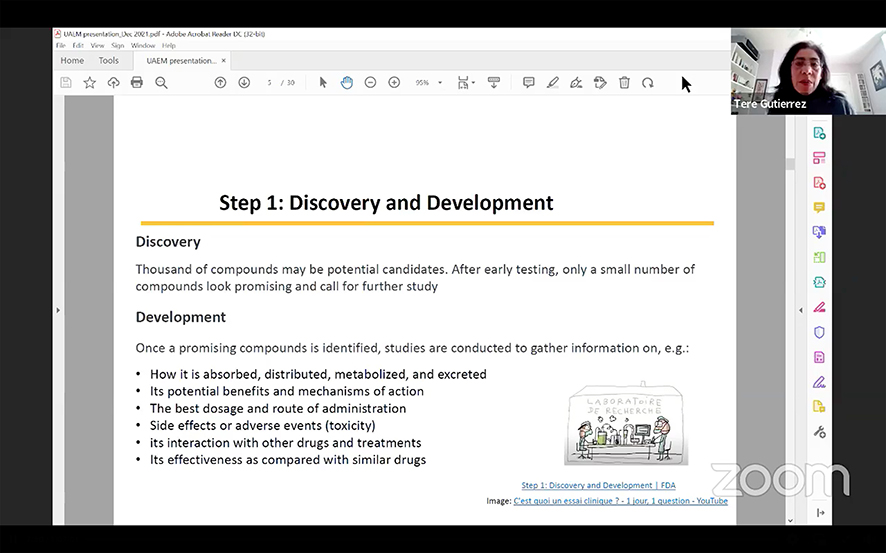
Sobre la etapa de descubrimiento de nuevos fármacos por parte de las empresas o laboratorios, explicó que puede haber miles de compuestos candidatos potenciales a fármacos, pero después de estudios iniciales solo un pequeño número de ellos pueden ser prometedores y son estudiados más en detalle, es ahí en donde entra la fase de desarrollo.
El estudio de estos compuestos abarca los procesos de cómo se absorben, se distribuyen o metabolizan, también cuál puede ser el mecanismo de acción y se empieza a ver cuál puede ser la mejor fórmula farmacéutica, la ruta de ministración, los efectos secundarios y algunos otros efectos que ayudan a decidir si puede ser adecuado para ser estudiado en animales y más tarde, llegar a la parte preclínica de investigación, cuyo objetivo es determinar si es o no tóxico, para ello, se usan ensayos en animales.
Finalmente, un proceso concluye cuando las compañías pueden enviar a las agencias regulatorias la solicitud para aprobar estos medicamentos y comercializarlos, siendo tan solo entre el 25 y el 30 por ciento de los fármacos estudiados los que se aprueban para iniciar el post marketing.
Fotos: Cortesía.